Carbonate de lithium CAS n° 554-13-2
étroitement engourdir: 554-13-2
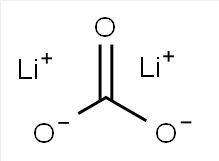
Formule chimique : LEÇON 3
Synonymes :
CP 15467-61
Sel de lithium de l'acide carbonique (Li2CO3)
Carbolithium
MOQ (Quantité minimale de commande) :1 FCL (chargement complet d'un conteneur)
Apparence:Poudre blanche
Carbonate de lithium CAS n° 554-13-2
Le carbonate de lithium (formule moléculaire Li₂CO₃) se présente sous forme de cristaux monocliniques incolores ou de poudre blanche. Sa densité est de 2,11 g/mol. Son point de fusion est de 618 °C. Il ne se déliquescent pas et est stable à l'air. Sa solubilité dans l'eau est faible et diminue avec l'augmentation de la température. Il est plus soluble dans l'eau froide que dans l'eau chaude. Il est soluble dans les acides dilués et insoluble dans l'alcool et l'acétone. L'introduction de dioxyde de carbone dans une suspension aqueuse de carbonate de lithium provoque sa transformation en carbonate acide de lithium, qui se dissout ensuite. Le chauffage de la solution de carbonate acide de lithium libère du dioxyde de carbone et entraîne la précipitation du carbonate de lithium. Cette propriété peut être exploitée pour éliminer les impuretés du carbonate de lithium. En raison de la forte polarisabilité de l'ion lithium, la stabilité thermique du carbonate de lithium est inférieure à celle des autres carbonates de métaux alcalins. Chauffé au-dessus de son point de fusion, il se décompose en dioxyde de carbone et en oxyde de lithium. Le carbonate de lithium est un solide cristallin monoclinique blanc. En général, le carbonate de lithium réagit avec des acides plus forts que le dioxyde de carbone ou l'acide carbonique pour former le sel de lithium de l'acide et du dioxyde de carbone. Ces réactions peuvent être réalisées en solution, sous forme de suspension aqueuse, ou, avec moins d'efficacité, avec du carbonate de lithium solide.
Le carbonate de lithium présente une faible solubilité dans l'eau pour un carbonate de métal alcalin. Cette solubilité diminue avec l'augmentation de la température. Il n'est pas hygroscopique et est généralement stable à l'air libre. De fait, il s'agit du composé final habituel rencontré lors de l'exposition à l'air de nombreux composés basiques du lithium. Le carbonate de lithium peut être dissous dans l'eau par conversion en hydrogénocarbonate. Le dégagement de dioxyde de carbone lors du chauffage d'une solution d'hydrogénocarbonate de lithium provoque la reprécipitation du carbonate de lithium.
Propriétés chimiques du carbonate de lithium |
Point de fusion |
720 °C |
Point d'ébullition |
1342 °C (litt.) |
densité |
2,11 g/mL à 25 °C |
densité apparente |
250 kg/avec |
Fp |
1310°C |
température de stockage |
Conserver entre +5°C et +30°C. |
solubilité |
13g/l |
pka |
pKa 6,38 (Incertain) ; 10,25 (Incertain) |
formulaire |
fil |
Gravité spécifique |
2.11 |
couleur |
Blanc |
PH |
10-11 (5 g/l, H2O, 20℃) |
Couleur de la flamme |
Bleu |
Odeur |
inodore |
Solubilité dans l'eau |
13 g/L (20 °C) |
Merck |
14 5527 |
Constante du produit de solubilité (Ksp) |
pKsp : 1,6 |
BRN |
3999191 |
Classe BCS |
1 |
Fonctions des ingrédients cosmétiques |
TAMPON |
InChIKey |
xgzfoxdbqdhffaisal |
LogP |
-0.809 (est) |
Référence de la base de données CAS |
554-13-2 (Référence de la base de données CAS) |
Référence de chimie du NIST |
carbonate de lithium (554-13-2) |
Système d'enregistrement des substances de l'EPA |
carbonate de lithium (554-13-2) |
Informations de sécurité |
Codes de danger |
Xn,C,F |
Déclarations de risques |
36/38-41-36/37/38-22-36-34-20/21/22-15-14-11 |
Consignes de sécurité |
8-43-45-37/39-26-36/37-24/25-36/37/39-16-7/8-3/7/9 |
WGK Allemagne |
2 |
RTECS |
OJ5800000 |
F |
10 |
TSCA |
Répertorié TSCA |
Code SH |
28369100 |
Données sur les substances dangereuses |
554-13-2 (Données sur les substances dangereuses) |
Toxicité |
DL50 par voie orale chez le rat : 0,71 g/kg (Smyth) |
Application du carbonate de lithium CAS n° 554-13-2
Carbonate de lithium : solide blanc, Li₂CO₃ ; densité relative : 2,11 ; point de fusion : 723 °C ; se décompose au-dessus de 1310 °C. Il est produit industriellement par traitement du minerai à l’acide sulfurique à 250 °C, suivi d’une lixiviation pour obtenir une solution de sulfate de lithium. Le carbonate est ensuite obtenu par précipitation avec une solution de carbonate de sodium. Le carbonate de lithium est utilisé dans la prévention et le traitement des troubles bipolaires. Il est également utilisé industriellement dans les émaux céramiques.
Salon des usines et des équipements
Délai de livraison rapide
Délai d'approvisionnement : 2 à 3 jours ouvrables. Délai de production : 7 à 10 jours ouvrables.